本項筆記為修習碩士班課程撰寫之課程筆記,主要用於準備考試之用途,故無完整收錄課程內容。
另為維護教科書版權,習題題目概不列出,如有錯誤歡迎提供修正建議。
【未經同意不得轉載】
課程使用之教科書為:
C. David Cooper and F. C. Alley. (2002). Air Pollution Control: A Design Approach (Third Edition). Waveland Pr Inc.
另外,單位換算部分於本筆記中概不列出。
基本概念回顧
單位
- ppm in gas:
理想氣體(
- 理想氣體之壓力與體積關係 (Boyle’s Law):壓力與體積成反比(
- 理想氣體之溫度、壓力與體積關係 (Avogadro’s Law):相同體積的理想氣體,在相同溫度及壓力下,具有相同數量的分子。
- 理想氣體之分壓 (Dalton’s Law):對於非反應性的理想氣體,總壓力等於各種氣體分壓總和(
- 可得知:
- 固定體積和溫度下:在非反應性混合理想氣體中,各組成氣體分壓比 = 各組成氣體莫爾數比。
- 固定溫度及壓力下:在非反應性混合理想氣體中,各組成氣體體積比 = 各組成氣體莫爾數比。
C10 Properties of Gases and Vapors
名詞解釋
- ★★★Henry’s Law Constant 亨利定律常數:
- 指污染物在氣體中的分壓以及液體中莫爾分率的比值(atm/莫爾分率)。
- ●Diffusivities 擴散
- 物質會自發性地從高濃度區域擴散到低濃度區域。
- 氣體和蒸氣的定義:
- 若一種物質的氣體狀態遠離液態狀態,則被視為真正的氣體,通常表示該物質的溫度高於其臨界點。另一方面,蒸氣是一種氣體狀態的物質,卻並未遠離液態狀態。
- Vapor Pressure 蒸氣壓
- 蒸氣壓被定義為某一純成分蒸氣在與其純液體表面達到平衡時所施加的壓力,該溫度為某一特定溫度。
- Henry’s law
- 翻譯: 對於稀薄溶液而言,氣體和液體中污染物的濃度呈正比。
10.2 蒸氣壓
蒸氣壓隨溫度上升而增加,其關係可描述為 Antoine Equation,如式 {10.1}:
- 其中,式 {10.1} 之參數指:
而在同時存在液相以及氣相時,在平衡狀態下,其分配符合:
- 其中,式 {10.2} 之參數指:
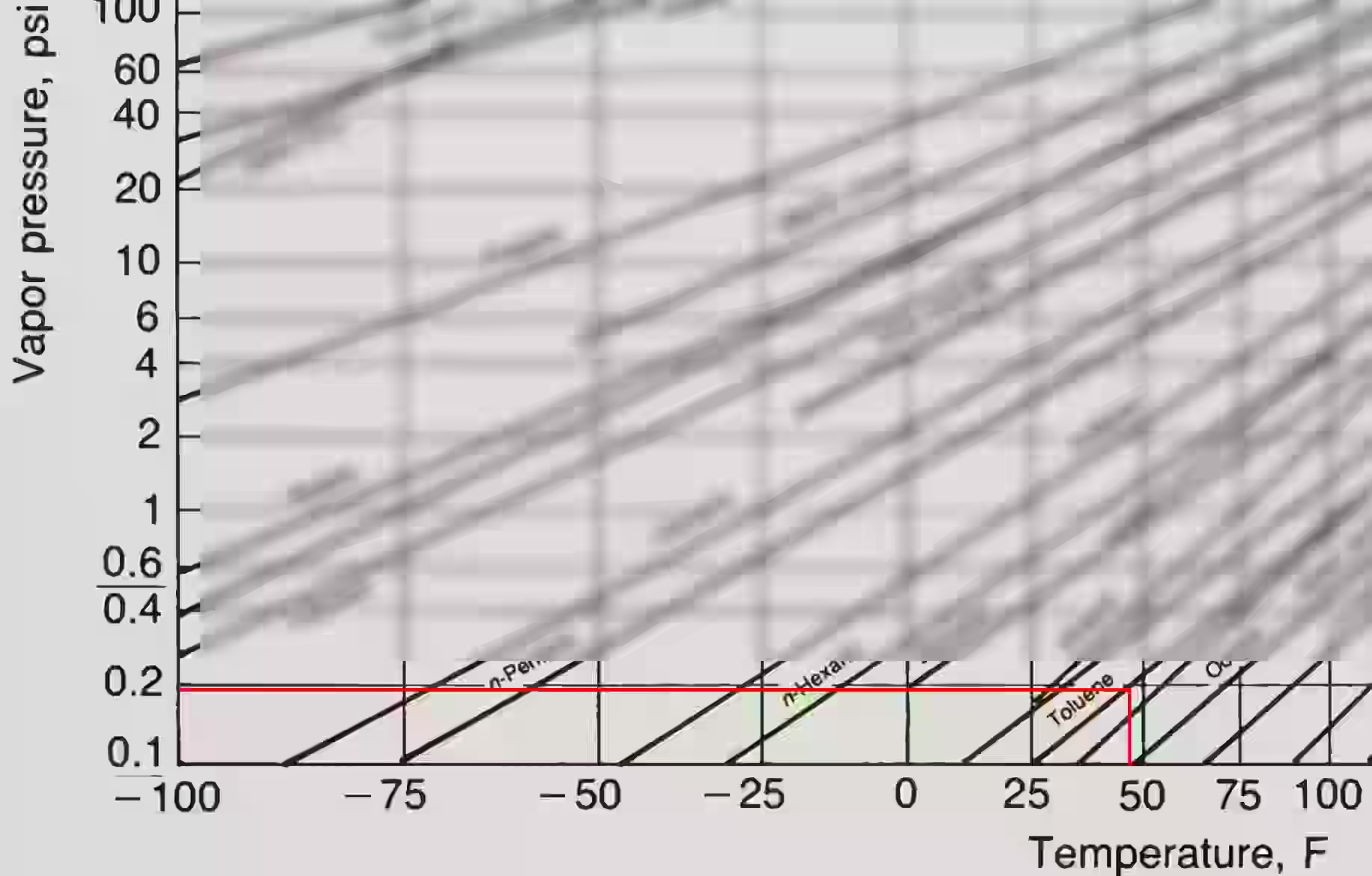
Example 10.1 (★Open Book)
- 分析題目:初始條件為一固定壓力、溫度及體積比的混合氣體,要透過降低溫度實現 2/3 的甲苯(Toluene)去除。
- 解題邏輯:尋找在相同壓力及體積條件下,可造成甲苯在氣相中莫爾分率僅剩原先 1/3 的溫度方案(根據式 {10.2} 以及 {圖-附件 B.1}),同理於冷凝去除了 2/3 的甲苯。
- 假設為理想氣體,在固定壓力(1 atm)、固定溫度(160 F)及固定體積下,可知各組成氣體體積比 = 各組成氣體莫爾數比 = 各組成氣體分壓比。
- 因此,體積分率為 40,000 ppm 之甲苯,可得知氣體分壓比亦為 40,000 ppm,故甲苯分壓為(為應用於 {圖-附件 B.1},故再將其轉為 psi 單位):
- 同時可知,在相同條件下,剩下 1/3 分壓表示目標分壓為:
- 依據 {圖-附件 B.1} 可知,目標溫度約為
10.4 氣液平衡(溶解)
氣液平衡
Henry’s Law:氣體在液體中的溶解度與氣體在液體上的分壓成正比,可描述為式 {10.6}:
- 其中,式 {10.6} 之參數指:
- 僅適用於稀薄溶液:隨著
Example 10.2
- 分析題目:氣液平衡問題。
- 解題邏輯:根據給定數據確定亨利常數帶入式 {10.6} 即可。
- 已知 CO 液相莫爾分率為
莫 爾 分 率 - 帶入式 {10.6} 可得:
莫 爾 分 率 液 相 莫 爾 分 率
10.3 化學反應
反應速率
當存在一化學反應可表示為
- 其中,式 {10.9} 之參數指:
阿瑞尼士方程式(Arrhenius Equation)
用於描述反應速率常數(
- 其中,式 {10.10} 之參數指:
反應器質量平衡
- 連續攪拌罐式反應器(Continuous Stirred Tank Reactor, CSTR):質量平衡如下式 {10.11}。
- 柱塞流反應器(Plug Flow Reactor, PFR):質量平衡如下式 {10.12},當流率不變時,可化簡為式 {10.13}。
- 其中,式 {10.11}、式 {10.12}、式 {10.13} 之參數指:
Comment: {10.13} 如何使用 {10.12} 導出?
Example 10.3
- 分析題目:給定不同溫度下的反應速率。
- 解題邏輯:根據阿瑞尼士方程式帶入式 {10.10} 求解即可。
- 將數值帶入阿瑞尼士方程式求解:
- 數值帶入:如式 {Example 10.3-1}。
- 上下相除求得
- 帶回任一式求得
- 得
Example 10.4(★)
- 分析題目:給定流量及反應參數,解 CSTR 與 PFR 反應器體積,。
- 解題邏輯:套用反應器質量平衡式 {10.11}、{10.12} 進行求解。
- 依據 Example 10.3 之結果以及阿瑞尼士方程式 {10.10} 重新計算適切之反應速率常數:
- 使用 CSTR 質量平衡式 {10.11} 計算反應器體積:
-
化學反應式為
- 目的為將
- 反應速率:
- 由於以反應物
- 在 CSTR 中,反應器內濃度等於出流濃度:
- 因此:
- 由於以反應物
- 目的為將
-
假設進/出流體積流率不變:
-
已知題目要求處理效率為 99%:
體 積 流 率 不 變 : 帶 入 濃 度 差 異 : 帶 入 反 應 速 率 : 重 新 整 理 方 程 :
Comment: 同理,可以使用生成物
若以生成物的視角看,儘管可以得到
此時:
因此可得:
體 積 流 率 不 變 : 初 始 沒 有 產 物 : 帶 入 反 應 速 率 : 化 學 平 衡 展 開 : 重 新 整 理 方 程 : -
- 設進/出流體積流率不變,因此使用 PFR 質量平衡式 {10.13} 計算反應器體積:
C11 VOC 焚化
13/03/2024 17:00
理論
基本概念
對於碳氫化合物,在焚化過程
其中:
焚化過程之重要因子
在焚化過程,為達良好的 VOC 破壞,有三個重要因子(簡稱 3T):
- Temperature(溫度)
- Time(時間):確保有足夠的時間使反應器達足夠溫度。
- Turbulenc(亂流):確保氧氣與 VOCs 充分混合。
並可對這三個重要因子建立關係式如 {11.10}、{11.11}、{11.12}:
可以使用 Damköhler numbers 了解其關係:
- 其中:
- 當
- 當
- 當
動力學
溫度設計方法包含以下三種:
- 比 VOCs 自燃溫度高數百度 F。
- 迴歸方法 {11.13}、{11.14}。
- 其中,式 {11.13}、{11.14} 之參數指:
- 其中,式 {11.13}、{11.14} 之參數指:
- 根據反應速率估算 {11.15} 至 {11.19}:
- 根據阿瑞尼士方程式 {11.15},可知當頻率因數(
- 其中,式 {11.15} 中的頻率因數(Pre-exponential Factor,
- 其中,式 {11.16} 之參數指:
- 其中,式 {11.16} 之參數指:
- 其中,式 {11.16} 中的碰撞率因子(Collision Rate Factor,
- 而阿瑞尼士方程式 {11.15} 中的活化能
- 其中,式 {11.18} 中的活化能(
- 其中,式 {11.18} 中的活化能(
- 而可由焚化的破壞效率
- 根據阿瑞尼士方程式 {11.15},可知當頻率因數(
Example 11.1(Open Book)
使用不同溫度設計方法進行溫度設計(共三種),分述如下:
Solution - 1
- 分析題目:已知目標物種,使用相較自燃溫度高數百度的溫度設計。
- 解題邏輯:先找到 VOCs 的自燃溫度,再添加一自訂的溫度。
- 查表({表 11.1}),了解 Toluene 的自燃溫度:可得自燃溫度為 1,026 F。
- 任意添加一數百度 F 之溫度:
Solution - 2
- 分析題目:已知目標破壞效率,並透過現成迴歸係數將參數帶入式 {11.13}、{11.14},了解指定降解率的所需溫度。
- 解題邏輯:鑒於題目給定的降解率並非 {11.13}、{11.14} 分別給定的 99.9% 與 99%(99.5%),而目標降解率介於二者之間,故可使用內插法得到可接受的設計。
- 首先求解 {11.13}、{11.14} 的
- Toluene(甲苯):化學式已知為
- 帶入 {11.13}、{11.14}。
- 內插法求得指定分解率之數值。
- Toluene(甲苯):化學式已知為
Solution - 3
- 分析題目:已知目標物種及破壞效率(
- 解題邏輯:已知目標物種及破壞效率,可藉由式 {11.19} 得到目標之反應速率(
- 首先透過式 {11.19} 確定目標反應速率(
- 取得頻率因數(
- 根據式 {11.16},需先取得
- 已知目標物種為 Toluene(甲苯),化學式為
- 根據圖 {圖 11.5} 可知
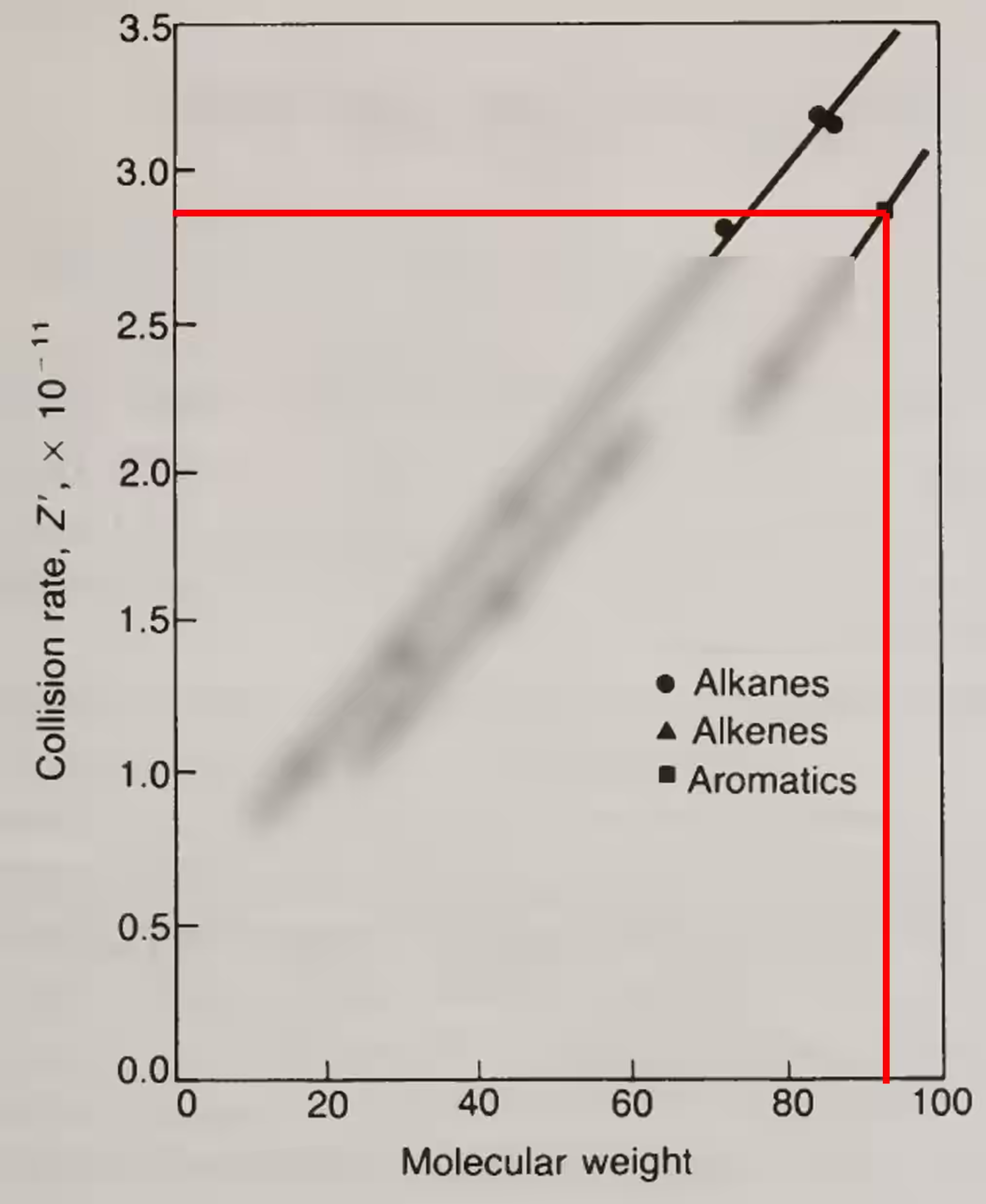
- 根據式 {11.17}估算
- 根據式 {11.16},可得頻率因數(
- 根據式 {11.16},需先取得
- 取得活化能(
- 帶入阿瑞尼士方程式 {11.15},求得目標溫度:
11.3 設計參數
質量平衡
對於一蒸氣焚化裝置,其質量平衡可歸納為式 {11.21},而焚化裝置設計主要需考量燃料添加量,可歸納如式 {11.24}。
而實務上,通常外部空氣與燃料會依一特定比例(
設備尺寸
- 反應室(Reaction Chamber)的長度(
- 體積流率(
- 反應室的直徑(
Example 11.2(Open Book)
Solution
- 分析題目:計算 Afterburner 的燃料質量流率(設計參數
- 解題邏輯:題目給定體積流率,需先依題目給定之氣體溫度查表({表-附件 B.2})取得氣體密度計算質量流率。以及依題目給定之氣體溫度查表({表-附件 B.7})以得知不同氣體之熱含量,帶入式 {11.24} 得到燃料質量流率。
- 已知:
- 單位換算,
- 廢氣 200 F,於表 {表-附件 B.2} 可得到空氣密度:
- 廢氣流率為 2,465 acfm,因此,廢氣的質量流率(
- 輸入空氣為 200 scfm,標準狀態為 70 F。同理可由表 {表-附件 B.2} 經內插法求得標準狀態之氣體密度為
- 廢氣 200 F,於表 {表-附件 B.2} 可得到空氣密度:
- 查表取得各氣體之熱含量,查表 {表-附件 B.7},經過內插或外插取得熱含量:
- 使用式 {11.24} 求解燃料質量流率:
Example 11.3
- 已知:
- 題目提供:
- Example 11.2 提供:
- 題目提供:
- Length(
- Diameter(
{11.29}~{11.31} 不重要
熱回收
- 其中:
後面 cost 部分不重要
C12 氣體吸附
前言
物理吸附與化學吸附
- 物理吸附(Physical adsorption)
- 透過凡德瓦力(van der Waals)進行吸附,相對較弱。
- 化學吸附(Chemical Adsorption, Chemisorption)
- 透過吸附質與吸附劑間產生化學鍵。
等溫吸附(Adsorption Isotherms)
Langmuir isotherm equation
- 前提假設:
- 吸附為單層。
- 達吸附平衡時,表示吸附速率與脫附速率相等。
根據定義可得下式 {12.1}:
- 其中,式 {12.1} 之參數指:
Freundlich isotherm equation
- 其中,式 {12.10} 之參數指:
Comment: {12.10} 如何使用 {12.1} 導出?
吸附速率()與脫附速率( )可根據下式 {12.2}、{12.3} 得知:
- 其中,式 {12.2}、{12.3} 之參數指:
:吸附速率。 :脫附速率。 、 :係數。 :吸附位點被占位之比例。 整理式 {12.2}、{12.3} 可得:
並且,與 成正比,可表示為式 {12.5}:
整理式 {12.4}、{12.5} 可得:
將常數項整併可得:
當分壓一般時,可簡化為:
12.4
- ★圖 12.4 會考


Pressure Drop 壓力降 Across Fixed Beds
- 其中,式 {12.13} 之參數指:
存在另一簡化版本如式 {12.14},僅適用於深度(D)介於 5~50 inches;流率 60~140 ft/min 之活性碳系統:
- 其中,式 {12.14} 之參數指:
13/04/2024 19:37
Example 12.1 (Open Book)
- 由題可知:
- 每次吸附與脫附各花
- 欲使用式 {12.13} 求解,經比對可知,尚餘
- 求
- 確定該吸附塔可吸附多少 Benzene:
- 計算活性炭總量:
活 性 碳 總 量 吸 附 劑 體 積 吸 附 劑 密 度 - 計算相當 Benzene 吸附量:
- 計算活性炭總量:
- 確定體積流率:
- 每次吸附使用
- 透過理想氣體方程式確定體積:
- 帶入其濃度並轉換為體積流率:
- 每次吸附使用
- 求得
- 確定該吸附塔可吸附多少 Benzene:
- 帶回式 {12.13} 求解得到
- 欲使用式 {12.14} 求解,經比對可知,尚餘
- 由前面得到的體積流率計算
- 帶回式 {12.14} 求解得到
脫附技術、估價不考
C13 吸收
13.1
- 理想的填料塔(Packed Tower)填充物符合:
- 高濕潤表面積 (High wetted area per unit volume)
- 重量輕 (Minimal weight)
- 耐化性佳 (Sufficient chemical resistance)
- 低液體保持率 (Low liquid holdup)
- 低壓力降 (Low pressure drop)
- 低成本 (Low cost)
13.2
Two-Film Theory
-
當:
-
前提假設:
- 氣液兩相界面間各存在一薄膜
- 通過介面後瞬間達平衡
-
質傳速率可以式 {13.1} 描述(當同時有 A、B 物質同時要擴散):
- 其中,式 {13.1} 之參數指:
- 其中,式 {13.1} 之參數指:
-
對於液膜(liquid film)可以式 {13.8} 描述:
- 其中,式 {13.8} 之參數指:
- 其中,式 {13.8} 之參數指:
Example 13.1 (★★★Open Book)
- 由題可知:
- (進流
- (使用 Pure water 吸附)
- (氣體進流流率):
- (進流
- 因此:
- 出流
, 相 當 於 。 故 :
- 出流
- 而在吸收過程中,可由表 {表-附件 B.4} 透過溶解度以及分壓評估:
-
由於:
分 壓
溶 解 量 溶 解 量 溶 質 重 溶 質 -
因此可由表 {表-附件 B.4} 列舉如下(Ammonia @ 86F=30C):
得 得 40 719 0.297521 0.946053 30 454 0.241071 0.597368 25 352 0.209302 0.463158 20 260 0.174757 0.342105 15 179 0.137056 0.235526 10 110 0.095745 0.144737 7.5 79.7 0.073569 0.104868 5 51 0.050279 0.067105 4 40.1 0.040632 0.052763 3 29.6 0.030787 0.038947 2 19.3 0.020737 0.025395 -
由
-
因此,假設吸附達穩態,則塔底液體之 Ammonia 莫爾分率為
-
- 透過式 {13.14} 求解塔頂流率:
-
已知式 {13.14}:
- 其中,式 {13.14} 之參數指:
- 其中,式 {13.14} 之參數指:
-
將參數帶入(將近流與出流當作同一個瞬間,因此此時
、
氣 體 流 率 液 體 流 率 -
由題已知水流率需為 1.5 倍。因此水流率為:
-
- 求蒸氣之質量通量速率(
- 為查圖 {圖 13.6},必須先有其 x 參數:
- 因此,得:
- 查圖 {13.6},當
- 其中,式 {13.14} 之參數指:
- 其中,式 {13.14} 之參數指:
- 其中:
- 因此可知
- 為查圖 {圖 13.6},必須先有其 x 參數:
- 現在,有通量(
- 已知:
- 又知:
- 為確保填充塔穩定,故取氣體質量通量的 50% 設計(40%~70% 皆可)。因此:
實 際 - 因此可計算得知填充塔所需面積:
實 際 - 故填充塔直徑設計為:
- 因此設計填充塔直徑為
- 已知:
- 開始求解填充塔高度(
- 已知,式 {13.21} 如下:
- 其中,式 {13.21} 之參數指:
, 蒸 氣 的 莫 爾 通 量 流 率
- 其中,式 {13.21} 之參數指:
- 已知塔設計面積,可求得
- 為計算
- 已知,式 {13.21} 如下:
- 求
- 已知式 {13.14}:
塔 頂 時 , ; 而 未 知 : - 因此,可得到操作線:
- 以前面畫的平衡曲線(Equilibrium Curve)為基礎(下圖中綠色實線)。
- 依剛才得到的相關式
- 定義斜率:
- 已知,式 {13.20} 如下所示:
- 假設
- 因此,斜率(
- 已知,式 {13.20} 如下所示:
- 繪圖,以確定操作前後之氣體莫爾分率(
- 確定初始操作點(y = 0.25 至 0.0164)至操作線之交點(下圖中紅色實線)。
- 自該交點依繪製斜率(下圖中紅色虛線)。
- 由斜率線與平衡曲線交叉處確定該操作點執行後之氣相莫爾分率(
- 可得到一系列
y y’ 0.025 0.008232 0.050 0.022827 0.075 0.038699 0.100 0.055629 0.125 0.073570 0.150 0.092595 0.175 0.112856 0.200 0.134556 0.225 0.157910 0.250 0.183122
- 繪製
- 已知式 {13.14}:
- 得填充塔高度:
- 計算壓力降:
- 同樣透過圖 {圖 13.6} 檢索。
- 確定最終參數:
實 際 - 查圖 {圖 13.6} 可知,當
- 因此:
C14
生物滴濾塔(Biotrickling Filter) vs. 生物濾床(Biofilter) vs. 生物洗滌塔(Bioscrubber)
-
(★Table 14.1 可能會考差異)
Application Biomass Water Phase Biofilter Fixed Fixed Biotrickling Filter Fixed Flowing Bioscrubber Flowing (suspended) Flowing -
生物滴濾塔主要用於親水性的污染物處理
-
生物濾床可以處理疏水性的污染物,但較難維持
-
生物洗滌塔通常效率較差
-
生物濾床去除性能:alcohols (best) → esters → ketones →aromatics → alkanes (worst).
-
生物濾床優點:
- Effective removal of compounds
- Little or no by-product pollutants produced (including CO and NOx)
- Uncomplicated installations
- Low costs
-
生物濾床缺點:
- Less suited to high concentration streams
- Large area needed for installation
- Careful attention to moisture control required
- May become clogged by particulate matter and/or biomass growth
-
亨利定律可調整如式 {14.1}:
- 其中,式 {14.1} 之參數指:
- 其中,式 {14.1} 之參數指:
Example 14.1
- 而現在要用的單位是
-
已知氣相中濃度為
-
帶回式 {14.1},求得
C15
Problem 15.1
- 已知:
- Sludge content = 0.55
- Sulfur content = 0.035
- Heating value =
- imestone composition = 0.95
- Limestone actual = 1.15 * Limestone theoretical
- 又已知:600 MW power plant;
- 計算輸入硫量:
- 計算污泥固體物質量,根據
- 算法 1:污泥固體物質量 = 石灰石輸入質量 - 石灰石消耗質量 + 生成物(CaSO3)質量
- 計算總輸入石灰石質量:
- 計算總消耗石灰石質量:
- 計算總產生生成物質量:
- 石灰石輸入質量-石灰石消耗質量+生成物(CaSO3)質量 =
- 計算總輸入石灰石質量:
- 算法 2:污泥固體物質量 = 石灰石輸入質量 - 生成 CO2 質量 + 反應物(SO2)參與質量
- 計算總輸入石灰石質量:
- 計算總生成 CO2 質量:
- 計算總參與反應物質量:
- 石灰石輸入質量-生成 CO2 質量 + 反應物(SO2)參與質量 =
- 計算總輸入石灰石質量:
- 算法 1:污泥固體物質量 = 石灰石輸入質量 - 石灰石消耗質量 + 生成物(CaSO3)質量
- 污泥量 = 污泥固體物質量 / 污泥固體物比例:
Problem 15.3
- 已知:
- Wellman-Lord FGD system:
- 從 Problem 15.1 可知:
輸入硫量 =
- Wellman-Lord FGD system:
- 故
C16
Problem 16.1
- 已知:
- 式 (16.4):
- T = 1,500 K
- 可得:
- 可得:
- 式 (16.4):
- 故:
Problem 16.2
Problem 16.7
- 已知:
- P = 1 atm
- T = 573 K
- NO:NH3 = 1:1
處 理 量
Problem 16.8
Problem 16.9
- 已知:
- 故:
C18
Problem 18.9
- 化學平衡:
- 已知:
- 計算:
Problem 18.10
Problem 18.11
Problem 18.12
- 由題已知:
- Exhaust gas ratio = 9.3 m³/liter @AFR=14.0
- Exhaust gas ratio = 10.2 m³/liter @AFR=14.9
- 由圖 18.3 可知:
- CO = 1.8% @AFR=14.0
- NO = 2,100 ppm @AFR=14.0
- CO = 0.4% @AFR=14.9
- NO = 3,000 ppm @AFR=14.9
- 計算:
Problem 18.15
- 化學平衡:
- (a):
- (b):
- (c):


